Western Blotting – Antikörperauswahl und Nachweisverfahren
Primäre und sekundäre AntikörperDie Bindung von Antikörpern ist für die Bindung und den Nachweis von Proteinen im Western Blotting entscheidend. Die primären Antikörper werden zu Beginn des Prozesses eingeführt, um an das Protein von Interesse zu binden. Der primäre Antikörper kann manchmal mit einem Farbstoff oder Enzym für die Nachweisphase konjugiert werden. Wenn dies jedoch nicht der Fall ist, ist ein sekundärer Antikörper erforderlich. Die sekundären Antikörper werden zum Nachweis des primären Antikörpers in den Medien verwendet. Die beiden Antikörper sollten gegen die gleiche Wirtsspezies gerichtet sein, d. h. wenn der primäre monoklonale Antikörper gegen Mäuse gerichtet ist, muss der sekundäre Antikörper ebenfalls gegen Mäuse gerichtet sein. Die Verwendung eines sekundären Antikörpers anstelle einer Enzym- oder Farbstoffnachweismethode bietet die Möglichkeit, Zeit und Ressourcen zu sparen. Die Verwendung von primären und sekundären Antikörpern ermöglicht den Prozess des Blot Stripping.
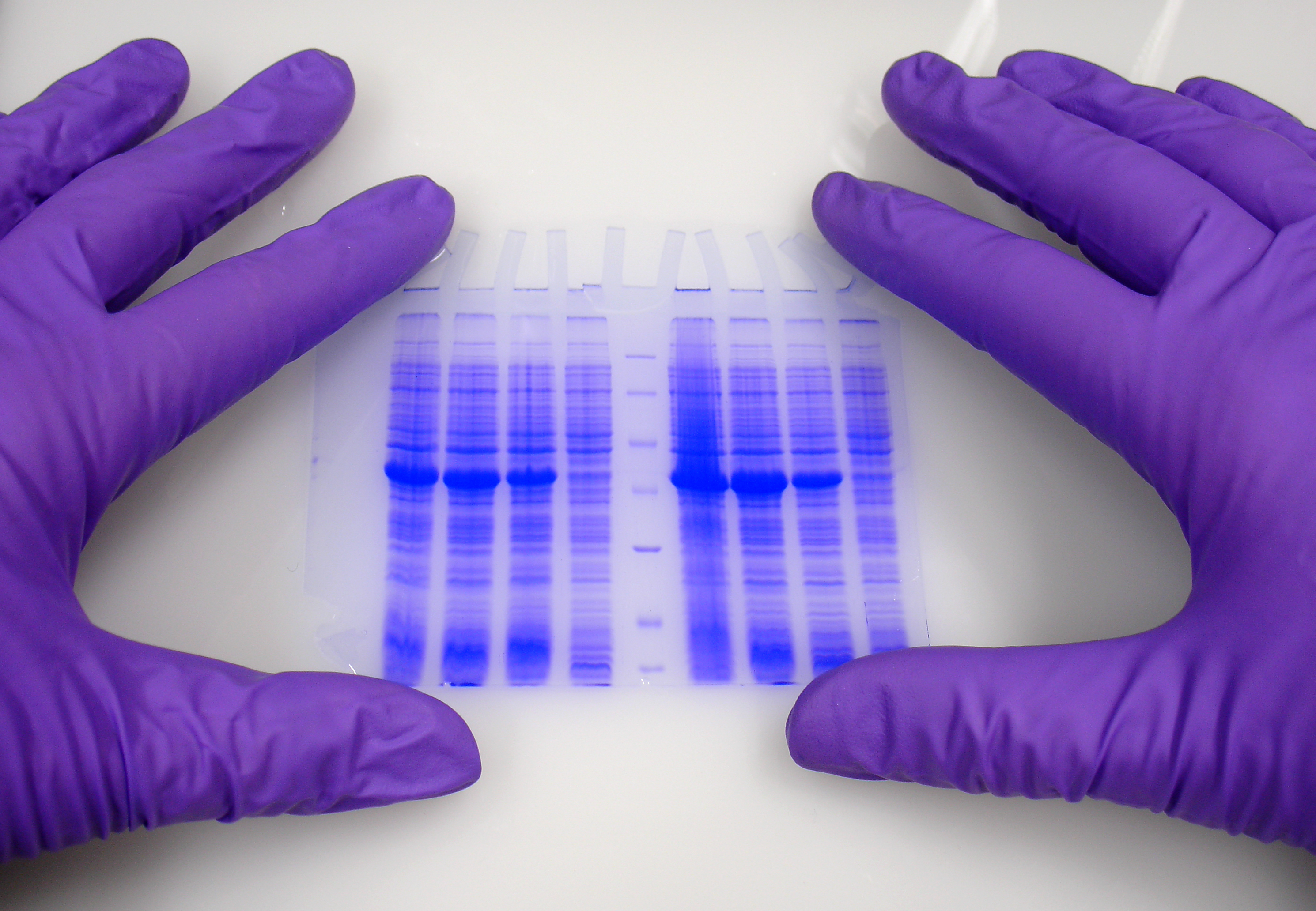
Das Blot Stripping hat drei wesentliche Vorteile. Mit dieser Technik werden die primären und sekundären Antikörper, die zum Nachweis eines Proteins verwendet wurden, vom Blot entfernt. Durch das Blot Stripping kann der Blot erneut untersucht werden, um weitere Proteine auf derselben Blot-Probe nachzuweisen. Darüber hinaus kann das Blot Stripping dazu verwendet werden, eine Ladekontrolle auf demselben Blot nachzuweisen. Dadurch werden Benutzerfehler oder Verzerrungen beim Nachweis des Zielproteins in der Probe ausgeschlossen. Und schließlich sorgt das Blot Stripping für eine größere Effizienz der Blot-Technik, da dieselbe Probe wiederverwendet werden kann. Die Möglichkeit, Proben wiederzuverwenden, trägt dazu bei, die Antikörperkonzentration zu optimieren, ohne Zeit oder Material für mehrere Gelläufe und Transfers zu verschwenden. Bei der Erstellung eines Blot-Stripping-Protokolls müssen Sie einige Überlegungen anstellen. Stripping-Methoden erfordern eine Kombination aus Detergenz, Reduktionsmittel, Hitze oder Puffern mit niedrigem pH-Wert, um die Antigen-Antikörper-Interaktionen zu schwächen. Ein erfolgreiches Blot Stripping sollte die Antikörper auswaschen und gleichzeitig eine Interferenz mit den Protein-Membran-Interaktionen vermeiden. Die Wahl der Membran, die Nachweismethode, die Stripping-Methode und die Sequenz des Proteinnachweises müssen kompatibel sein. Das Stripping kann nur dann erfolgreich sein, wenn Sie Nachweismethoden wie Elektrochemilumineszenz (ECL) oder fluoreszierende Methoden verwenden und keine kolorimetrischen Methoden, die sichtbare Flecken auf der Membran hinterlassen. Es wird empfohlen, vorrangig Antikörper mit niedriger Affinität zu verwenden, um Proteine mit geringer Abundanz nachzuweisen. Dies ist darauf zurückzuführen, dass bei jedem zusätzlichen Stripping auf einem einzelnen Gel ein gewisser Antigenverlust unvermeidlich ist. Wenn Sie einen Blot wiederverwenden, ist es wichtig, die gestrippte Membran vor der Wiederverwendung gründlich zu waschen und erneut zu blockieren, um eine unspezifische Bindung von Antikörpern an die Membran zu verhindern. NachweismethodenDie Detektion auf einem Western Blot ist die Technik, die die Visualisierung der Ergebnisse ermöglicht. Es gibt verschiedene Nachweismethoden: durch eine enzymatische Reaktion oder durch konjugierte Antikörper, die direkt sichtbar gemacht werden können. Kolorimetrische TechnikBei der kolorimetrischen Technik wird durch eine enzymatische Reaktion ein farbiges Präzipitat erzeugt. Diese Technik ist im Allgemeinen einfacher zu handhaben und erfordert keine teuren Materialien wie Röntgenfilme oder einen Entwickler. Die Kolorimetrie hat einen geringeren Pikogramm-Bereich als andere Techniken und bietet daher einen Empfindlichkeitsbereich von etwa 5–500 pg Protein mit einem einzigen Ausgangssignal. ChemolumineszenzDie Chemolumineszenz ist eine hochempfindliche Nachweismethode, die häufiger eingesetzt wird als kolorimetrische Methoden. Als Nebenprodukt einer Reaktion zwischen einem chemischen Substrat und einem Enzym wird Licht erzeugt. Die Intensität des Lichts wird dann durch Belichtung mit einem Röntgenfilm oder einem ladungsgekoppelten Gerät (CCD), das Photonen in ein elektronisches Signal umwandelt, gemessen. Die Chemilumineszenz bietet zwei Methoden mit unterschiedlichen Vor- und Nachteilen. Die Chemilumineszenz mittels Filmdetektion ist eine hochempfindliche Methode zum Nachweis von Proteinen im Femtogramm-Bereich. Es handelt sich um eine teurere Methode, die Film, Entwickler und eine Dunkelkammer erfordert. Röntgen/CCD ist in der Regel einfacher zu handhaben und linearer als Film, erfordert aber oft eine teurere Ausrüstung und eine umfassende Schulung. FluoreszenzDie Fluoreszenz ist die bisher am häufigsten verwendete Nachweismethode im Western Blotting. Anstatt sich auf eine enzymatische Reaktion zu verlassen, um ein Signal zu erzeugen, werden Antikörper an ein spezifisches Fluorophor konjugiert, das mit einem Bildgebungssystem analysiert werden kann. Dies ermöglicht einen weitaus größeren Linearitätsbereich als die bisherigen Nachweismethoden. Die Fluoreszenz ermöglicht die gleichzeitige Untersuchung mehrerer Proteine unter Verwendung verschiedener Fluorophore. Dies kann eine erhebliche Zeitersparnis bedeuten, da die Suche nach Proteinen mit ähnlichem Molekulargewicht möglich ist. Derzeit gibt es verschiedene Bildgebungssysteme für den Nachweis von Ergebnissen beim Western Blotting mit Fluoreszenz, z. B. sichtbares Licht, LED oder Infrarotlaser.
ElektronentransfersystemeNeben den Tank- und halbtrockenen Transfermethoden gibt es eine Vielzahl von Transfermethoden, die innerhalb dieser Systeme eingesetzt werden können. Die beliebteste Methode ist heute das Elektroblotting oder der Elektrotransfer. Diese schnelle und effektive Transfermethode kann auf nassen, halbtrockenen und trockenen Transfersystemen eingesetzt werden. Ein Elektronentransfersystem wird so eingerichtet, dass das Gel in direktem Kontakt mit einem Teil der Membran steht, der für die Proteinbindung formuliert wurde. Diese beiden Schichten werden anschließend zwischen zwei Elektroden platziert, die entweder in Puffer getaucht (Tanksysteme) oder mit puffergesättigten Filterpapieren umhüllt sind (trockene und halbtrockene Systeme). Beim Elektroblotting wird ein elektrisches Feld angelegt, wodurch die Proteine vom Gel auf die Oberfläche der Membran wandern, wo sie an das Medium gebunden werden. Tanktransfer (nass)Nasstransfers sind die traditionelle Methode des Blotting, die ein längeres Zeitfenster von 30–120 Minuten erfordern. Die Verwendung eines Puffers ist für diese Technik von entscheidender Bedeutung und sie erfordert häufig eine Methanollösung. Dies verlangt wiederum nach umfangreicheren Reinigungsprotokollen und der Entsorgung von Gefahrstoffen. Halbtrockene TransfersHalbtrockene Transfers sind wesentlich schneller als ein standardmäßiger Tanktransfer und nehmen etwa 7–10 Minuten in Anspruch. Es werden zwar weiterhin Puffer benötigt, es ist jedoch für eine korrekte Durchführung kein Methanol erforderlich. Diese äußerst vielseitige Technik sorgt für einen etwas einfacheren Prozess mit weniger Ausfallzeiten und weniger Reinigungsarbeiten. Einer der größten Vorteile des halbtrockenen Transfers besteht darin, dass mehrere Methoden verwendet werden können, wodurch sich die Möglichkeit ergibt, das Protokoll individuell anzupassen. Trockenes ElektroblottingDer Trockentransfer erfordert keine Pufferlösung und bietet die schnellste Transferzeit von insgesamt 5–7 Minuten. Bei dieser Methode wird statt Tanks oder getränkten Filterpapieren eine Gelmatrix verwendet, die einen Puffer enthält. Trockentransfersysteme sind unglaublich einfach in der Anwendung, bieten eine hohe Transferleistung und erfordern im Vergleich zu anderen Transfermethoden nur minimalen Reinigungsaufwand. Vor- und Nachteile des ElektronentransfersEmpfindlichkeit und GenauigkeitDas Western Blotting bietet die Möglichkeit, Proteine bis zu einer Größe von 0,1 Nanogramm in einer Probe nachzuweisen, was sie zu einem idealen Werkzeug für die Frühdiagnostik macht. Diese erhöhte Empfindlichkeit verringert auch den Bedarf an Antikörpern, sodass weniger Tests erforderlich sind und die Laborkosten erheblich gesenkt werden können. Western Blot ist auch für den Nachweis von Proteinen verlässlich präzise. Das liegt daran, dass die Elektrophorese die Proteine aus Ihrer Probe nach Größe, Ladung und Konformation sortiert. Die Spezifität wird auch durch die Interaktion von Antikörper und Antigen unterstützt, die den Nachweis eines Zielproteins in einer komplexen Mischung erleichtert. Dies ist für über 300.000 verschiedene Proteine in einer bestimmten Probe möglich. Subjektive Ergebnisse und kostspielige AnforderungenObwohl Western Blot präzise Ergebnisse liefern kann, kann es auch zu irreführenden Ergebnissen kommen, wenn die Technik fehlerhaft ist. Wenn ein Antikörper mit einem nicht beabsichtigten Protein reagiert, wie z. B. bei parasitären Infektionen, kann es zu falsch-positiven Ergebnissen kommen. Wenn größeren Proteine nicht genügend Zeit für den Transfer gegeben wird, können falsch-negative Ergebnisse entstehen. Wenn Blotting-Techniken ungenau sind, führen sie oft zu verblassten, verzerrten Banden, die von einem Labortechniker interpretiert werden müssen. Es ist wichtig, Kontrolltests durchzuführen und jeden Schritt des Western-Blot-Prozesses zu verstehen, um klare und zuverlässige Ergebnisse zu erhalten. Für einen erfolgreichen Blot sind eine entsprechende Ausbildung und Laborausrüstung erforderlich. Das Verständnis von Reagenzienkonzentrationen, Inkubationszeiten und Nachweisprotokollen erfordert eine umfassende Schulung und sollte von qualifiziertem Laborpersonal durchgeführt werden. Fazit Ganz gleich ob Transfermembranen, Blotting-Kits, bestimmte Reagenzien, Transfersysteme oder einzigartige Antikörper, Avantor hat die Lösungen für Ihren Laborbedarf. Auf unserer Website finden Sie umfangreiche Dienstleistungen und Ressourcen, die Ihren Laboralltag erleichtern. |
|
Bitte warten Sie...Ihre Daten werden bearbeitet |